编辑 | 紫罗
蛋白质、药物和其他生物分子之间的相互作用,在各种生物过程中发挥着至关重要的作用。了解这些相互作用对于破译生物学过程背后的分子机制和开发新的治疗策略至关重要。 蛋白质是细胞中最重要的分子之一,它们在细胞内执行各种功能。药物通常通过与特定的蛋白质相互作用来调节生理过程。这些相互作用可以促进或抑制特定的分子信号传递途
当前的多尺度计算方法,常常过于依赖于单一尺度,而对其他尺度的拟合不足。这可能与多尺度学习的不平多尺度向性和固有的贪婪性有关。
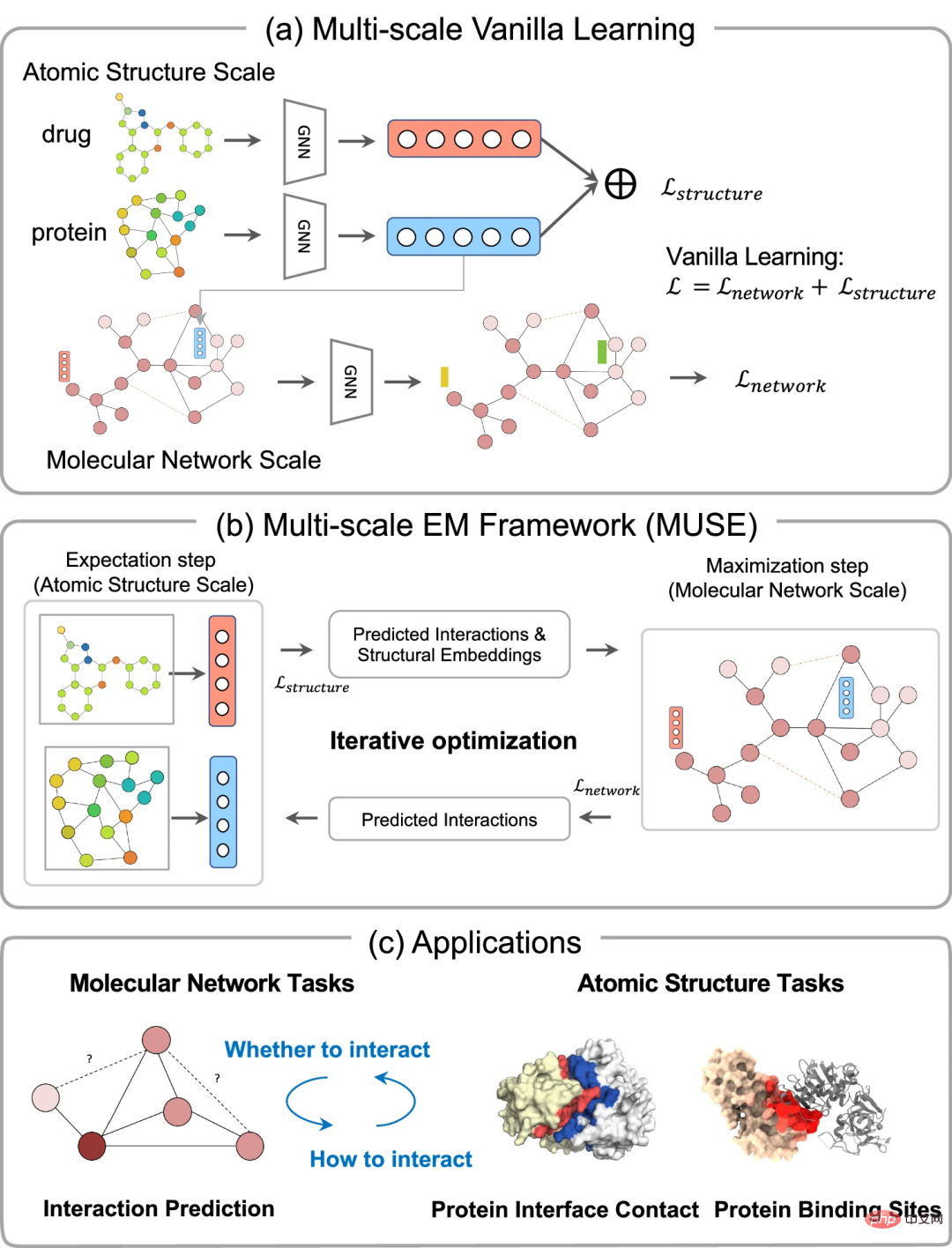
为了缓解优化不平衡,中山大学和上海交通大学的研究人员提出了一种基于变量期望最大化的多尺度表示学习框架 MUSE,它可以有效地整合多尺度信息进行学习。该策略通过相互监督和迭代优化,有效融合原子结构和分子网络尺度之间的多尺度信息。这种方法可以提供更大程度的信息传递和学习。该策略通过相互监督和迭代优化,有效融合原子结构和分子网络尺度之间的多尺度信息。
MUSE+不仅在分子相互作用(蛋白质-蛋白质、药物-蛋白质和药物)任务方面优于当前最先进的模型,而且在原子结构尺度的蛋白质界面预测方面也优于当前最先进的模型。更重要的是,多尺度学习框架可扩展到其他尺度的计算药物发现。
该研究以「A variational expectation-maximization framework for balanced multi-scale learning of protein and drug interactions」为题,于 5 月 25 日发布在《Nature Communications》上。

蛋白质功能的特点是与蛋白质、药物和其他生物分子的相互作用。了解这些相互作用对于破译生物过程的分子机制和开发新的治疗策略至关重要。然而,与实验相互作用相关的需求和成本的大幅增长,需要计算工具来自动预测和理解生物分子之间的相互作用。 为了满足这些需求和成本的增长,需要计算工具来自动预测和理解生物分子之间的相互作用。
纯粹从结构预测这些相互作用是结构生物学中最重要的挑战之一。目前的计算方法大多基于分子网络或结构信息来预测相互作用,并没有将它们集成到统一的多尺度框架中。
虽然一些多视图学习方法致力于融合多尺度信息,学习多尺度表示的直观方法是将分子图与交互网络结合起来并共同优化它们。然而,由于多尺度学习的不平衡性和固有的贪婪性,这些模型通常集中依赖于单一尺度。无法有效地利用所有尺度相关的信息,并且泛化差。
此外,有效的多尺度框架不仅需要捕获不同尺度内的丰富信息,而且还需要很好地保留它们之间的潜在关系。
在此,中山大学研究团队提出了 MUSE,一种基于变量期望最大化(Expectation Maximization)的多尺度表示学习框架,它可以在多次迭代的交替过程中优化不同尺度。与严重依赖单尺度信息的现有方法相比,MUSE 通过相互监督和迭代优化,有效解决了多尺度学习中的优化不平衡问题。
MUSE 是一种多尺度学习方法,通过变分期望最大化(EM)框架,将分子结构建模和蛋白质与药物相互作用网络学习相结合。EM 框架在多次迭代的交替过程中优化两个模块,即期望步骤(E-step)和最大化步骤(M-step)。
在 E-step 期间,MUSE 利用每个生物分子的结构信息来学习有效的结构表示,以便在 M-step 中使用已知的相互作用和增强样本进行训练。它将蛋白质和药物对及其原子级结构信息作为输入,并通过 M-step 预测的相互作用进行增强。M-step 将分子级相互作用网络、结构嵌入和 E-step 的预测相互作用作为输入,并输出预测的相互作用。E-step 和 M-step 之间的迭代优化确保了分子结构和网络信息的交互捕获,并在两个尺度上具有不同的学习率。
相互监督确保每个尺度模型以适当的方式学习,从而能够利用不同尺度的有效信息。该框架将在蛋白质和药物之间相互作用的多个多尺度中得到证明。分析了 MUSE 减轻了多尺度学习中的不平衡特征,并有效地整合了来自不同尺度的分层和互补信息。
利用原子结构信息改进分子网络尺度的预测
为了评估其方法,首先,研究人员利用 MUSE 整合原子结构信息来改进分子网络尺度(scale)预测。MUSE 在蛋白质-蛋白质相互作用(PPI)、药物-蛋白质相互作用(DPI)和药物-药物相互作用(DDI)这三个多尺度相互作用预测任务上取得了最先进的表现。
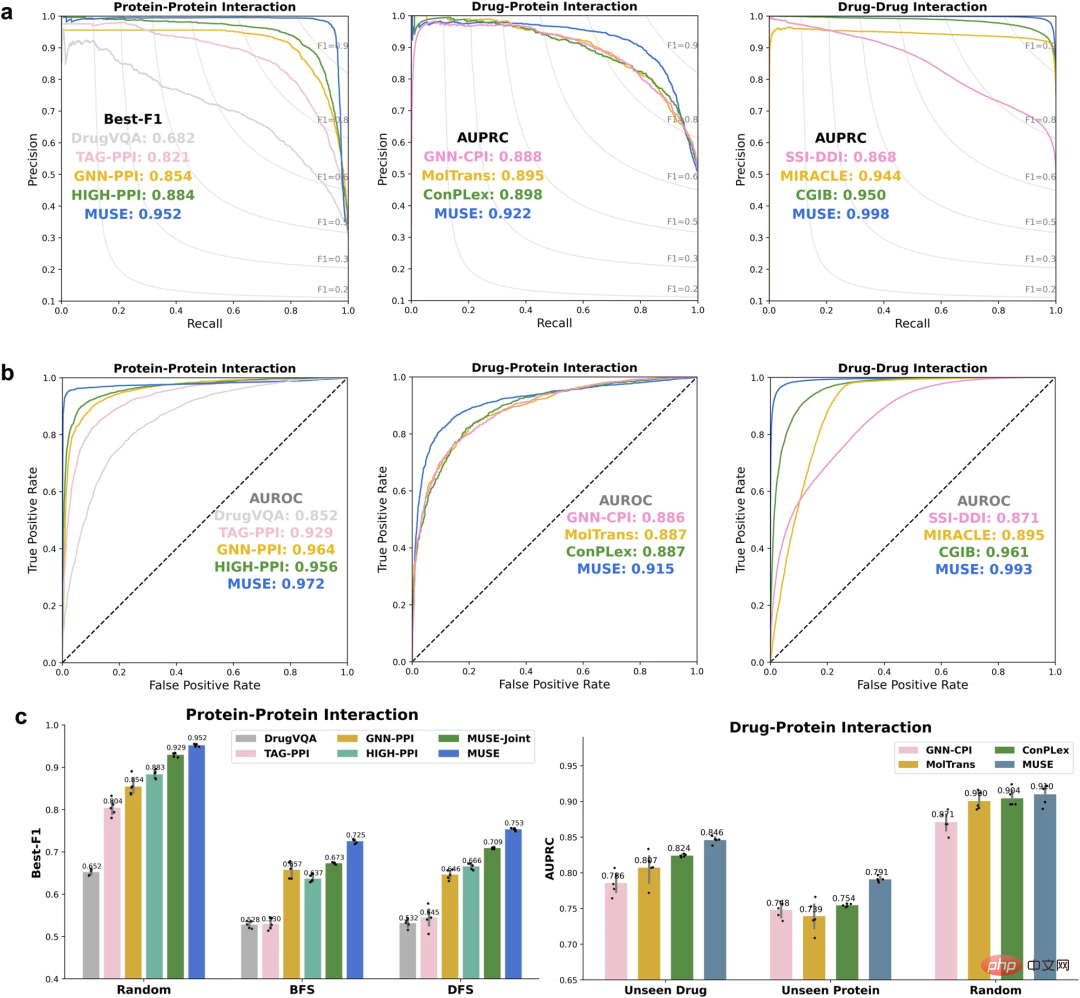
从分子网络尺度改进原子结构尺度的预测
除了利用原子结构信息改进分子网络尺度预测之外,研究人员还进一步研究了 MUSE 在原子结构尺度上学习和预测结构特性的能力,包括预测与 PPI 相关的界面接触和结合位点。
为了评估蛋白质链间接触的预测,将 MUSE 与 DIPS-Plus 基准测试中最先进的方法进行了比较。MUSE 始终优于所有其他方法,验证了其在原子结构预测中的有效性和适应性。
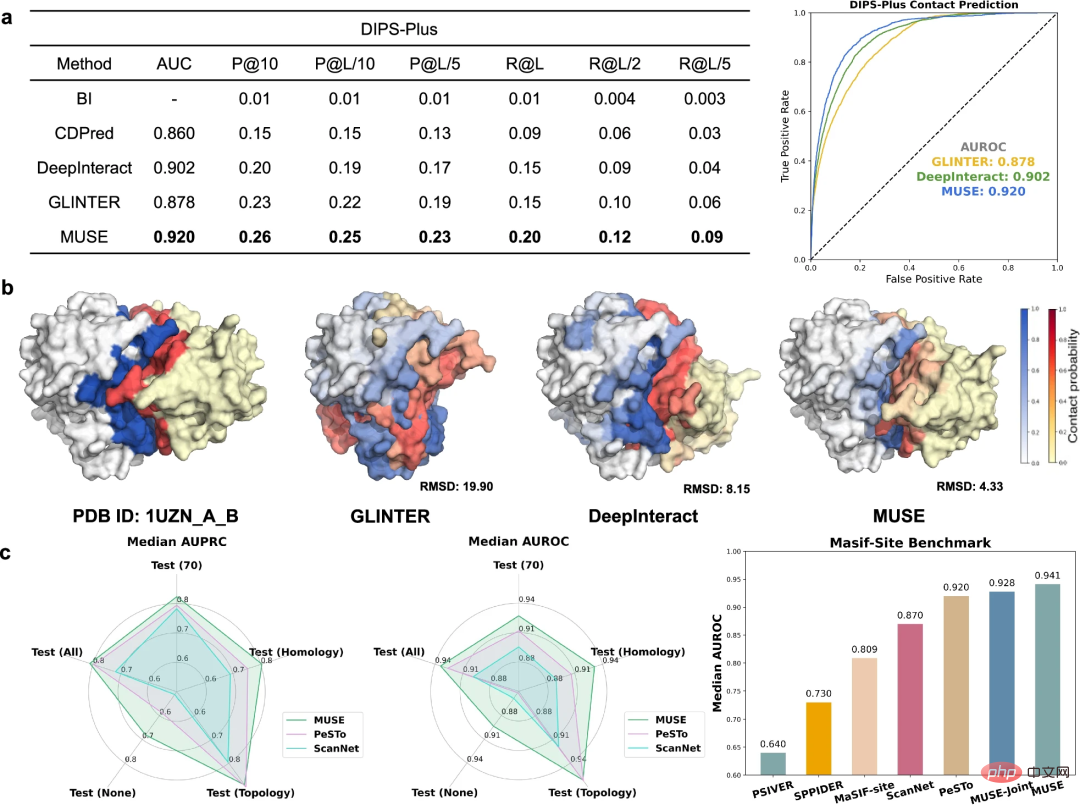
进一步评估 MUSE 以预测残基是否直接参与蛋白质-蛋白质相互作用。结果表明,MUSE 中分子网络规模的学习可以为原子结构尺度的预测提供有价值的见解。
通过迭代优化缓解多尺度学习的不平衡特性
为了探究为什么 MUSE 能够取得多尺度表示的优越性能,研究人员针对多尺度学习的不平衡特性分析了 MUSE 的学习能力。
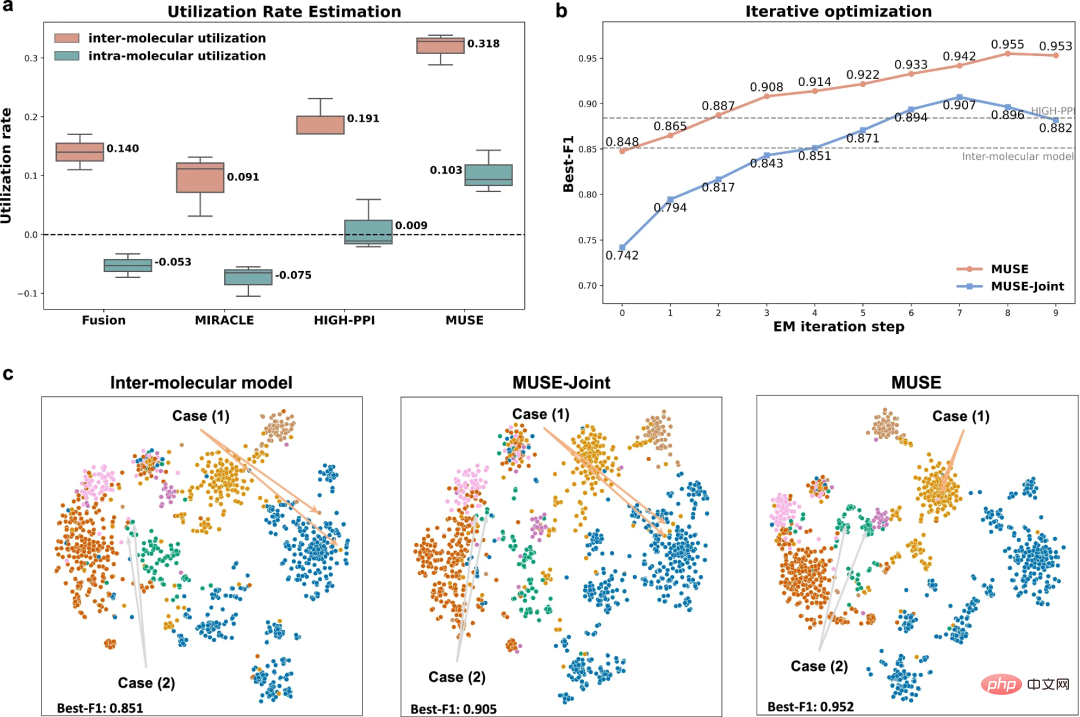
结果表明,MUSE有效缓解了多尺度学习中的不平衡特性和贪婪学习,保证了训练过程中不同尺度信息的综合利用。此外,利用率(utilization rate)分析的实验使研究人员能够具体了解模型学到了什么,并证明使用 MUSE 来平衡模型在不同尺度上的学习可以增强泛化能力。
所学习的多尺度表征的可视化和解释
为了更好地理解学习到的多尺度表示,研究人员从不同的角度研究了 MUSE 学习到的多尺度表示,包括(1)MUSE 捕获 PPI 中涉及的原子结构信息(即结构基序和嵌入)的能力,以及(2)学习到的原子结构和分子网络表示之间的相互监督。
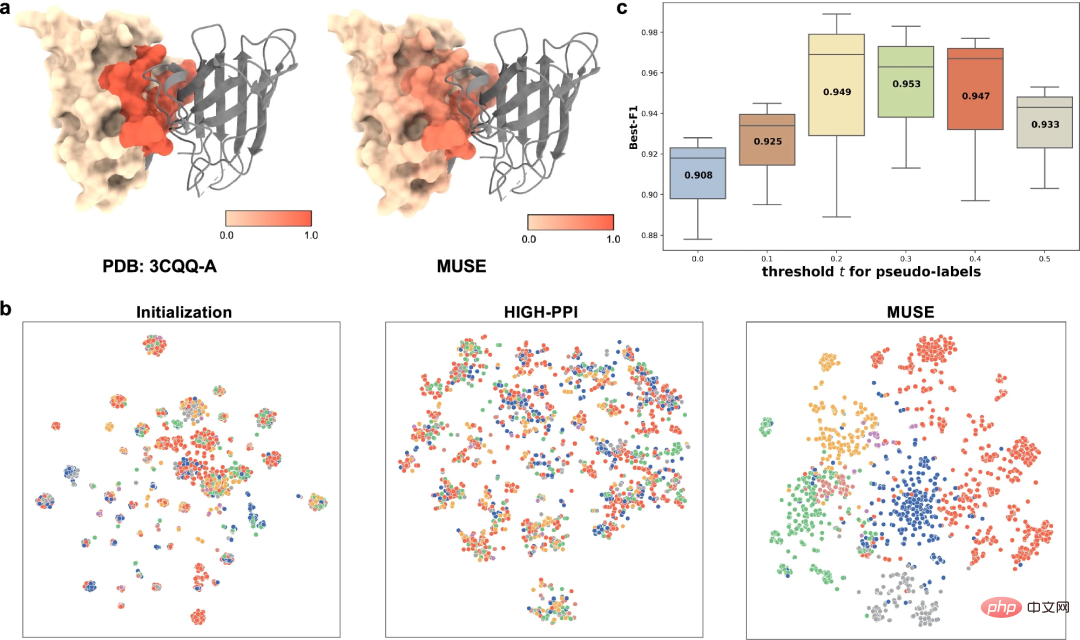
作为结合位点预测的示例(PDB id:3CQQ-A),MUSE 可以准确识别属于结合位点的残基,准确率为 97.7%。这表明 MUSE 中的相互监督有助于原子结构尺度模型学习与相互作用相关的关键子结构。
最后,研究人员还进行了消融研究,来研究原子结构尺度预测的伪标签对分子网络尺度的影响。
虽然 MUSE 在基准测试中展示了最先进的性能,但仍有可能提高其处理噪声和不完整的多尺度下游任务的能力。这可以通过知识图和可解释的 AI 技术将先验知识结合起来。另一方面,该概念性多尺度框架也可扩展到其他尺度的计算药物发现。
以上是SOTA性能,多尺度学习,中山大学提出蛋白质-药物相互作用AI框架的详细内容。更多信息请关注PHP中文网其他相关文章!




