テクノロジー周辺機器
テクノロジー周辺機器
 AI
AI
 量子機能と 20,000 の分子動力学シミュレーションを組み合わせた、新しいタンパク質-リガンド複合体 ML データセットが Nature サブジャーナルに掲載されました。
量子機能と 20,000 の分子動力学シミュレーションを組み合わせた、新しいタンパク質-リガンド複合体 ML データセットが Nature サブジャーナルに掲載されました。
量子機能と 20,000 の分子動力学シミュレーションを組み合わせた、新しいタンパク質-リガンド複合体 ML データセットが Nature サブジャーナルに掲載されました。

編集者 | Dry Leaf Butterfly
大規模な言語モデルにより、生物学と化学を理解する科学者の能力は大幅に向上しましたが、構造ベースの創薬、量子化学、および構造生物学のための信頼できる方法は依然として少数です。大規模な言語モデルでは、正確な生体分子とリガンドの相互作用データセットが緊急に必要とされています。
この問題を解決するために、ミュンヘンヘルムホルツ研究センター生物学研究所とミュンヘン工科大学の研究者がMISATOを提案しました。これは、小分子の量子力学 (QM) 特性と、約 20,000 の実験用タンパク質-リガンド複合体の関連する分子動力学 (MD) シミュレーション、および実験データの広範な検証を組み合わせたデータセットです。
研究者たちは、既存の実験構造から始めて、半経験的な量子力学を使用してこれらの構造を体系的に改善しました。これらには、蓄積時間が 170 マイクロ秒を超える、純水中の多数のタンパク質-リガンド複合体の分子動力学シミュレーションが含まれます。
チームは、このデータセットを使用することで精度が向上したことを示す機械学習 (ML) ベースライン モデルの例を提供しています。機械学習の専門家に、創薬用の次世代人工知能モデルを実装するための簡単なエントリ ポイントを提供します。
この研究は「MISATO: 構造ベースの創薬のためのタンパク質-リガンド複合体の機械学習データセット」と題され、2024年5月10日に「Nature Computational Science」に掲載されました。

近年、AI 予測技術は科学分野に革命を引き起こしています。たとえば、AlphaFold はタンパク質の構造を正確に予測できます。構造に基づく創薬は依然として大きな課題ですが、この分野での AI の応用はまだ浅いです。現在の手法は、精度、計算コスト、実験への依存などの課題に直面しており、主に単純な解決策と 1 次元データ処理に焦点を当てています。三次元タンパク質-リガンド複合体の複雑さは見落とされてきました。
さまざまなデータベースが存在しますが、データ量の制限と熱力学情報の欠如により、創薬を促進する AI モデルは示されていません。タンパク質構造予測の分野におけるAlphaFoldの成果とは異なり、AIモデルは力学や化学的複雑さなどの問題を無視しているため限界もあり、生体分子分析や量子化学における可能性に影響を与える。
ここで、ミュンヘンヘルムホルツ研究センターの構造生物学研究所とミュンヘン工科大学の研究者は、実験的なタンパク質-リガンド構造に基づくタンパク質-リガンド構造データベース、MISATO (Molecular Interactions Are Structurally Optimized) を提案しました。
研究者らは、データベースが創薬関連分野やそれ以外の分野でモデルをより適切にトレーニングするのに役立つことを示しました。これには、量子化学、一般的な構造生物学、生物情報学が含まれます。

チームは、配位子の幾何学形状の正則化を含む、量子化学ベースの構造管理と改良を提供します。研究者らは、時間スケールでの MD を含む、欠落している動的および化学情報でこのデータベースを強化し、特定のシステムの過渡的および不可解な状態の検出を可能にしました。後者は医薬品設計を成功させるために非常に重要です。

したがって、研究者たちは、最大数の物理パラメータを実験データに追加しました。これにより、AI モデルはこのすべての情報を暗黙的に学習する負担から解放され、主要な学習タスクに集中できるようになります。 MISATO データベースは、機械学習コードに直接インポートできる使いやすい形式を提供します。

チームは、データセットをフィルタリングして視覚化するためのさまざまな前処理スクリプトも提供しています。さらに、量子化学特性 (化学的硬度と電子親和力) の計算、結合親和力の計算、タンパク質の柔軟性や誘導フィット特性の予測用の AI ベースライン モデルの例が提供されているため、データを簡素化できます。さらに、QM、MD、AI モデルは実験データに基づいて広範囲に検証されています。
研究者らは、MISATOを創薬分野全体に利益をもたらす有益なコミュニティプロジェクトに変えたいと考えています。
論文リンク:https://www.nature.com/articles/s43588-024-00627-2
以上が量子機能と 20,000 の分子動力学シミュレーションを組み合わせた、新しいタンパク質-リガンド複合体 ML データセットが Nature サブジャーナルに掲載されました。の詳細内容です。詳細については、PHP 中国語 Web サイトの他の関連記事を参照してください。

ホットAIツール

Undresser.AI Undress
リアルなヌード写真を作成する AI 搭載アプリ

AI Clothes Remover
写真から衣服を削除するオンライン AI ツール。

Undress AI Tool
脱衣画像を無料で

Clothoff.io
AI衣類リムーバー

AI Hentai Generator
AIヘンタイを無料で生成します。

人気の記事

ホットツール

メモ帳++7.3.1
使いやすく無料のコードエディター

SublimeText3 中国語版
中国語版、とても使いやすい

ゼンドスタジオ 13.0.1
強力な PHP 統合開発環境

ドリームウィーバー CS6
ビジュアル Web 開発ツール

SublimeText3 Mac版
神レベルのコード編集ソフト(SublimeText3)

ホットトピック
 7364
7364
 15
15
 1628
1628
 14
14
 1353
1353
 52
52
 1265
1265
 25
25
 1214
1214
 29
29
 DeepMind ロボットが卓球をすると、フォアハンドとバックハンドが空中に滑り出し、人間の初心者を完全に打ち負かしました
Aug 09, 2024 pm 04:01 PM
DeepMind ロボットが卓球をすると、フォアハンドとバックハンドが空中に滑り出し、人間の初心者を完全に打ち負かしました
Aug 09, 2024 pm 04:01 PM
でももしかしたら公園の老人には勝てないかもしれない?パリオリンピックの真っ最中で、卓球が注目を集めています。同時に、ロボットは卓球のプレーにも新たな進歩をもたらしました。先ほど、DeepMind は、卓球競技において人間のアマチュア選手のレベルに到達できる初の学習ロボット エージェントを提案しました。論文のアドレス: https://arxiv.org/pdf/2408.03906 DeepMind ロボットは卓球でどれくらい優れていますか?おそらく人間のアマチュアプレーヤーと同等です: フォアハンドとバックハンドの両方: 相手はさまざまなプレースタイルを使用しますが、ロボットもそれに耐えることができます: さまざまなスピンでサーブを受ける: ただし、ゲームの激しさはそれほど激しくないようです公園の老人。ロボット、卓球用
 初のメカニカルクロー!元羅宝は2024年の世界ロボット会議に登場し、家庭に入ることができる初のチェスロボットを発表した
Aug 21, 2024 pm 07:33 PM
初のメカニカルクロー!元羅宝は2024年の世界ロボット会議に登場し、家庭に入ることができる初のチェスロボットを発表した
Aug 21, 2024 pm 07:33 PM
8月21日、2024年世界ロボット会議が北京で盛大に開催された。 SenseTimeのホームロボットブランド「Yuanluobot SenseRobot」は、全製品ファミリーを発表し、最近、世界初の家庭用チェスロボットとなるYuanluobot AIチェスプレイロボット - Chess Professional Edition(以下、「Yuanluobot SenseRobot」という)をリリースした。家。 Yuanluobo の 3 番目のチェス対局ロボット製品である新しい Guxiang ロボットは、AI およびエンジニアリング機械において多くの特別な技術アップグレードと革新を経て、初めて 3 次元のチェスの駒を拾う機能を実現しました。家庭用ロボットの機械的な爪を通して、チェスの対局、全員でのチェスの対局、記譜のレビューなどの人間と機械の機能を実行します。
 クロードも怠け者になってしまった!ネチズン: 自分に休日を与える方法を学びましょう
Sep 02, 2024 pm 01:56 PM
クロードも怠け者になってしまった!ネチズン: 自分に休日を与える方法を学びましょう
Sep 02, 2024 pm 01:56 PM
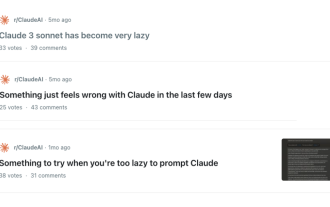
もうすぐ学校が始まり、新学期を迎える生徒だけでなく、大型AIモデルも気を付けなければなりません。少し前、レディットはクロードが怠け者になったと不満を漏らすネチズンでいっぱいだった。 「レベルが大幅に低下し、頻繁に停止し、出力も非常に短くなりました。リリースの最初の週は、4 ページの文書全体を一度に翻訳できましたが、今では 0.5 ページの出力さえできません」 !」 https://www.reddit.com/r/ClaudeAI/comments/1by8rw8/something_just_feels_wrong_with_claude_in_the/ というタイトルの投稿で、「クロードには完全に失望しました」という内容でいっぱいだった。
 世界ロボット会議で「未来の高齢者介護の希望」を担う家庭用ロボットを囲みました
Aug 22, 2024 pm 10:35 PM
世界ロボット会議で「未来の高齢者介護の希望」を担う家庭用ロボットを囲みました
Aug 22, 2024 pm 10:35 PM
北京で開催中の世界ロボット会議では、人型ロボットの展示が絶対的な注目となっているスターダストインテリジェントのブースでは、AIロボットアシスタントS1がダルシマー、武道、書道の3大パフォーマンスを披露した。文武両道を備えた 1 つの展示エリアには、多くの専門的な聴衆とメディアが集まりました。弾性ストリングのエレガントな演奏により、S1 は、スピード、強さ、正確さを備えた繊細な操作と絶対的なコントロールを発揮します。 CCTVニュースは、「書道」の背後にある模倣学習とインテリジェント制御に関する特別レポートを実施し、同社の創設者ライ・ジエ氏は、滑らかな動きの背後にあるハードウェア側が最高の力制御と最も人間らしい身体指標(速度、負荷)を追求していると説明した。など)、AI側では人の実際の動きのデータが収集され、強い状況に遭遇したときにロボットがより強くなり、急速に進化することを学習することができます。そしてアジャイル
 Li Feifei 氏のチームは、ロボットに空間知能を与え、GPT-4o を統合する ReKep を提案しました
Sep 03, 2024 pm 05:18 PM
Li Feifei 氏のチームは、ロボットに空間知能を与え、GPT-4o を統合する ReKep を提案しました
Sep 03, 2024 pm 05:18 PM
ビジョンとロボット学習の緊密な統合。最近話題の1X人型ロボットNEOと合わせて、2つのロボットハンドがスムーズに連携して服をたたむ、お茶を入れる、靴を詰めるといった動作をしていると、いよいよロボットの時代が到来するのではないかと感じられるかもしれません。実際、これらの滑らかな動きは、高度なロボット技術 + 精緻なフレーム設計 + マルチモーダル大型モデルの成果です。有用なロボットは多くの場合、環境との複雑かつ絶妙な相互作用を必要とし、環境は空間領域および時間領域の制約として表現できることがわかっています。たとえば、ロボットにお茶を注いでもらいたい場合、ロボットはまずティーポットのハンドルを掴んで、お茶をこぼさないように垂直に保ち、次にポットの口がカップの口と揃うまでスムーズに動かす必要があります。 、そしてティーポットを一定の角度に傾けます。これ
 ACL 2024 賞の発表: HuaTech による Oracle 解読に関する最優秀論文の 1 つ、GloVe Time Test Award
Aug 15, 2024 pm 04:37 PM
ACL 2024 賞の発表: HuaTech による Oracle 解読に関する最優秀論文の 1 つ、GloVe Time Test Award
Aug 15, 2024 pm 04:37 PM
貢献者はこの ACL カンファレンスから多くのことを学びました。 6日間のACL2024がタイのバンコクで開催されています。 ACL は、計算言語学と自然言語処理の分野におけるトップの国際会議で、国際計算言語学協会が主催し、毎年開催されます。 ACL は NLP 分野における学術的影響力において常に第一位にランクされており、CCF-A 推奨会議でもあります。今年の ACL カンファレンスは 62 回目であり、NLP 分野における 400 以上の最先端の作品が寄せられました。昨日の午後、カンファレンスは最優秀論文およびその他の賞を発表しました。今回の優秀論文賞は7件(未発表2件)、最優秀テーマ論文賞1件、優秀論文賞35件です。このカンファレンスでは、3 つの Resource Paper Award (ResourceAward) と Social Impact Award (
 宏蒙スマートトラベルS9とフルシナリオ新製品発売カンファレンス、多数の大ヒット新製品が一緒にリリースされました
Aug 08, 2024 am 07:02 AM
宏蒙スマートトラベルS9とフルシナリオ新製品発売カンファレンス、多数の大ヒット新製品が一緒にリリースされました
Aug 08, 2024 am 07:02 AM
今日の午後、Hongmeng Zhixingは新しいブランドと新車を正式に歓迎しました。 8月6日、ファーウェイはHongmeng Smart Xingxing S9およびファーウェイのフルシナリオ新製品発表カンファレンスを開催し、パノラマスマートフラッグシップセダンXiangjie S9、新しいM7ProおよびHuawei novaFlip、MatePad Pro 12.2インチ、新しいMatePad Air、Huawei Bisheng Withを発表しました。レーザー プリンタ X1 シリーズ、FreeBuds6i、WATCHFIT3、スマート スクリーン S5Pro など、スマート トラベル、スマート オフィスからスマート ウェアに至るまで、多くの新しいオールシナリオ スマート製品を開発し、ファーウェイは消費者にスマートな体験を提供するフル シナリオのスマート エコシステムを構築し続けています。すべてのインターネット。宏孟志興氏:スマートカー業界のアップグレードを促進するための徹底的な権限付与 ファーウェイは中国の自動車業界パートナーと提携して、
 中国初の大型UIモデル登場! Motiff の大規模モデルはデザイナーにとって最適なアシスタントを作成し、UI デザインのワークフローを最適化します
Aug 19, 2024 pm 04:48 PM
中国初の大型UIモデル登場! Motiff の大規模モデルはデザイナーにとって最適なアシスタントを作成し、UI デザインのワークフローを最適化します
Aug 19, 2024 pm 04:48 PM
人工知能は想像を超えるスピードで発展しています。 GPT-4 がマルチモーダル技術を一般に公開して以来、マルチモーダル大型モデルは急速な開発段階に入り、純粋なモデルの研究開発から垂直分野での探査と応用へと徐々に移行し、あらゆる分野に深く統合されています。インターフェイス インタラクションの分野では、Google や Apple などの国際的なテクノロジー大手が、携帯電話 AI 革命を前進させる唯一の方法とみなされている大規模なマルチモーダル UI モデルの研究開発に投資してきました。このような状況の中で、中国初の大規模UIモデルが誕生しました。 8月17日、国際エクスペリエンスデザインカンファレンス「IXDC2024」において、AI時代のデザインツールであるMotiffは、独自開発したUIマルチモーダルモデル「Motiff Model」を発表した。世界初のUIデザインツールです