
Les protéines sont vitales à la vie et jouent un rôle dans presque tous les processus biologiques. D’une part, ils peuvent transmettre des signaux entre neurones, identifier des envahisseurs microscopiques et activer des réponses immunitaires. D’autre part, les protéines ont été largement étudiées comme médiateurs thérapeutiques dans le cadre du traitement de maladies. Ainsi, en générant de nouvelles structures protéiques physiquement pliables, la porte est ouverte à de nouvelles façons d’exploiter les voies cellulaires pour traiter les maladies.
Dans cet article, des chercheurs de l'Université de Stanford, de Microsoft Research et d'autres institutions, inspirés par le processus de repliement des protéines in vivo, ont introduit un modèle de diffusion de repliement (folding diffusion, FoldingDiff), qui reflète les processus naturels de repliement des protéines pour concevoir des protéines. structures de base.

Plus précisément, ils décrivent la structure du squelette protéique comme une série continue d'angles pour capturer les orientations relatives des résidus d'acides aminés constitutifs, et le déplacement inhérent et l'invariance en rotation de cette représentation sont extrêmes. atténue le besoin de réseaux équivariants complexes.
Cette étude a formé un modèle probabiliste de diffusion débruité basé sur le squelette du transformateur et a démontré que notre modèle peut générer de manière inconditionnelle des structures protéiques très réalistes avec une complexité et des modèles structurels similaires aux protéines natives.
Certains internautes ont dit : Je me demande si ce modèle apportera une certaine concurrence à AlphaFold.
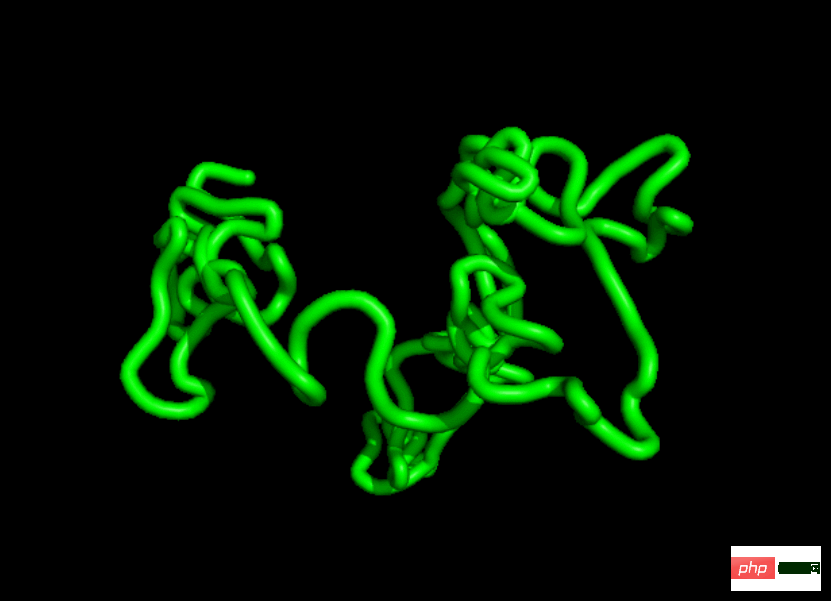
Nous pouvons comprendre les protéines comme des chaînes de résidus d'acides aminés de longueur variable. Il existe 20 acides aminés typiques, partageant le même squelette N-C_α-C à trois atomes, mais avec des côtés différents. les chaînes sont attachées à l’atome C_α (généralement noté R, voir Figure 1).
Ces résidus s'assemblent pour former des chaînes polymères qui se replient en structures 3D dont la forme détermine en grande partie la fonction de la protéine. Ces structures repliées peuvent être décrites à l'aide de quatre niveaux :
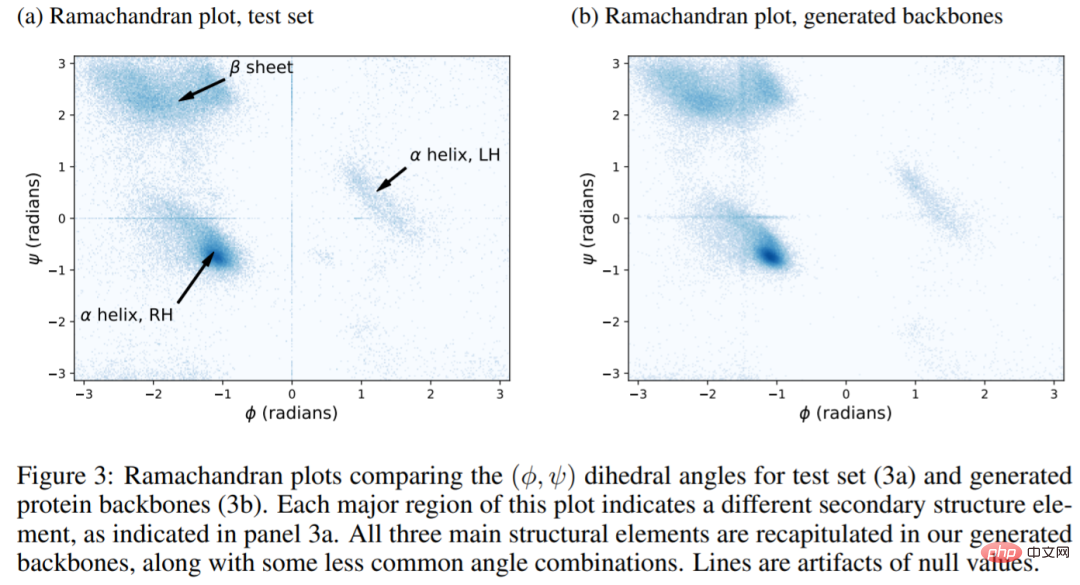
L'image ci-dessous montre les résultats d'une expérience. Le diagramme de Ramachandran de la structure naturelle (figure a) contient trois régions correspondant à l'hélice α LH, à l'hélice α RH et au feuillet β. Les trois régions sont entièrement reproduites dans la structure générée ici (Fig. 3b). En d’autres termes, FoldingDiff est capable de générer des éléments de structure secondaires au sein du squelette protéique. De plus, des expériences montrent que le modèle FoldingDiff apprend correctement que les hélices α RH sont plus courantes que les hélices α LH. Les travaux antérieurs utilisant des réseaux équivariants n'ont pas permis de distinguer ces deux types de spirales.
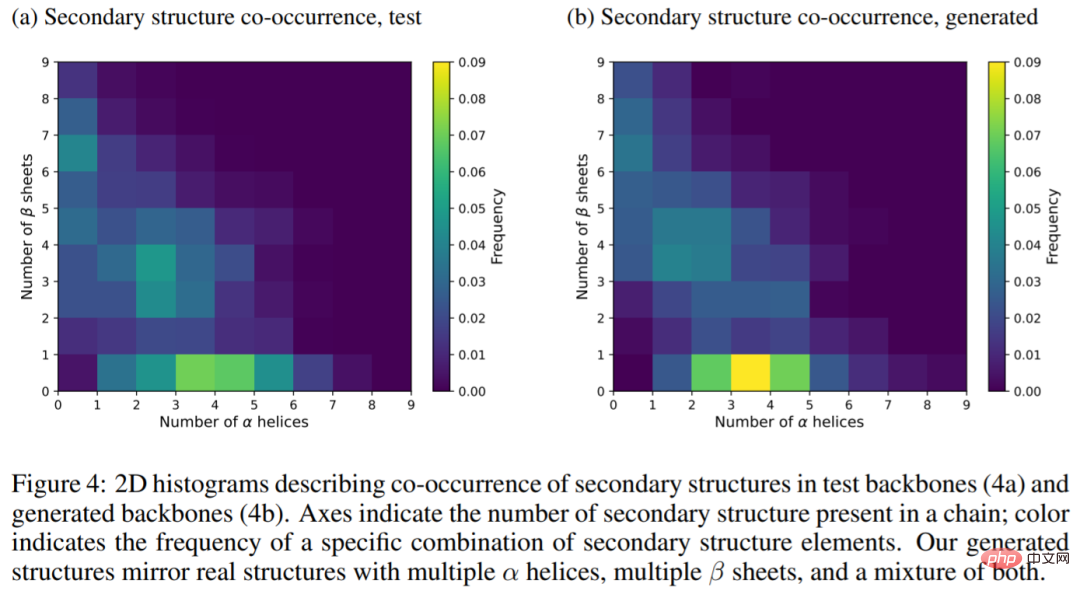
L'image ci-dessous montre l'histogramme bidimensionnel de la structure secondaire dans la chaîne principale de test (4a) et la chaîne principale générée (4b). Les résultats montrent que la structure générée reflète la vraie structure. de la protéine, avec plusieurs hélices alpha, plusieurs feuilles bêta et un mélange des deux.
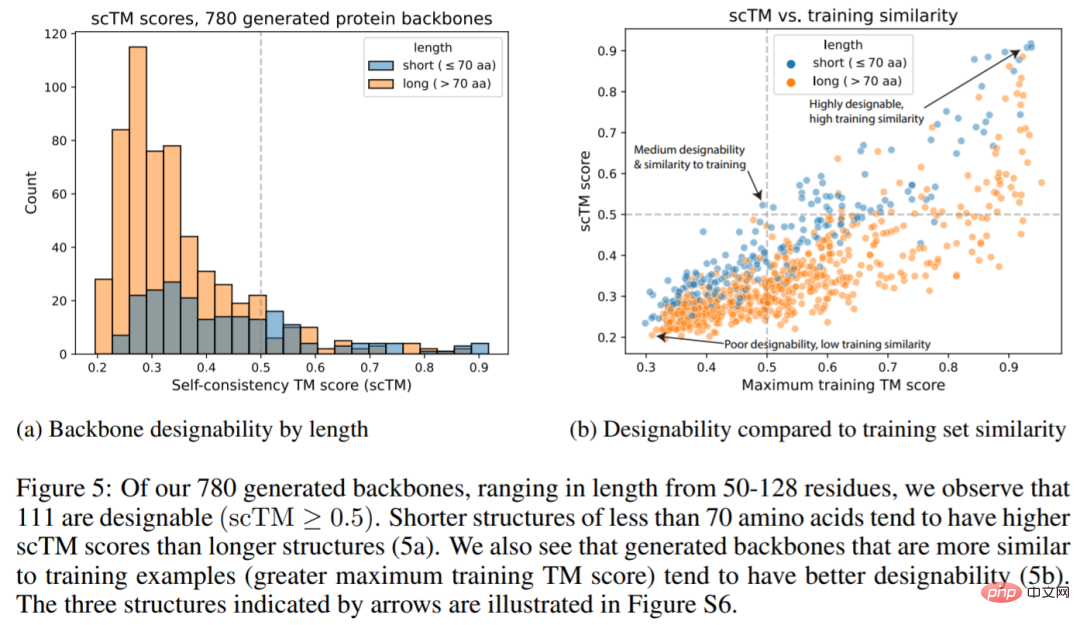
La figure ci-dessous montre que 111 des 780 structures générées (14,2 %) sont concevables avec un score scTM ≥0,5 (Fig. 5a), ce qui est supérieur à celui rapporté par Trippe et al. 11,8%. Nous voyons également que les chaînes principales générées sont plus similaires aux exemples de formation et ont tendance à avoir une meilleure conception (5b).
Pour plus d'informations, veuillez lire l'article original.
Ce qui précède est le contenu détaillé de. pour plus d'informations, suivez d'autres articles connexes sur le site Web de PHP en chinois!
 Comment utiliser la fonction choisir
Comment utiliser la fonction choisir
 La différence entre ancrer et viser
La différence entre ancrer et viser
 Qu'est-ce que la rigidité de l'utilisateur
Qu'est-ce que la rigidité de l'utilisateur
 Comment prendre des captures d'écran sur un ordinateur
Comment prendre des captures d'écran sur un ordinateur
 Comment activer le système de version professionnelle Win7
Comment activer le système de version professionnelle Win7
 Connexion Internet impossible
Connexion Internet impossible
 analyses statistiques
analyses statistiques
 Comment créer un clone WeChat sur un téléphone mobile Huawei
Comment créer un clone WeChat sur un téléphone mobile Huawei